![]()
![]()
![]()
Use LEFT and RIGHT arrow keys to navigate between flashcards;
Use UP and DOWN arrow keys to flip the card;
H to show hint;
A reads text to speech;
14 Cards in this Set
- Front
- Back

איזה מבנה זה? מה האורך של סיבוב שלם (ח. אמינו ומרחק)? מה כיווניות המבנה? אילו קשרים מייצבים את מבנה זה? לאן פונים השיירים של ח. האמינו? |
Alpha-Helix, שניוני. 3.6 ח. אמינו משלימות סיבוב שלם באורך של 5.6 אנגסטרם. זהו Alpha-Helix ימני. ייצוב המבנה הוא על ידי קשרי מימן בין האטומים של הקשר הפפטידי בלבד! חמצן בעמדה n יוצר קשר מימן עם החנקן הנמצא בעמדה n+4. שיירי חומצות האמינו פונות אל מחוץ לסליל! |
|
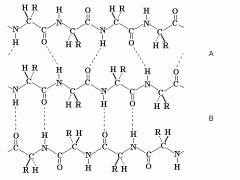
איזה מבנה זה? מה ההבדל בין A ל-B? מי מהם יותר יציב? |
Beta-Sheet, שניוני. A - Parallel B - Anti-Parallel הקשרים בקונפורמציה הלא מקבילה הם ישרים, לעומת הקונפרמציה המקבילה ששם הקשרים מתקיימים בזווית). דבר זה מחזק את הקשרים בקונפורמציה הלא מקבילה. בנוסף, המבנה המקביל הוא פחות פתוח מאשר המבנה הלא מקביל. |
|
|
כיצד השאפרונים עוזרים בקיפול החלבון? |
על ידי כך שהם "מתיישבים" על החלבון באיזורים שונים ומונעים ממנו להתקפל ולהגיע למבנה התלת מימדי הספונטני שלו (כתוצאה מכוחות דחייה ומשיכה של החלבון עם הסביבה ועם עצמו). השאפרונים מעכבים את הקיפול הספונטני ומאפשרים לשרשרת החלבונית להגיע לקיפול הנכון והפעיל של החלבון. * חלבון שנוצר ללא שפרונים יהיה מורכב ברובו מסליל אלפא בעוד שעם השאפרונים מתאפשרת יצירה של קפלי בטא * |
|
|
מהי הפעילות של סוגי האנזימים הבאים? 1. Oxidoreductases 2. Transferases 3. Hydrolases 4. Lyases 5. Isomerases 6. Lygases |
1. Oxidoredutases - אנזימים המזרזים ראקציות חמצון/חיזור. 2. Transferases - אנזימים המזרזים ראקציות העברה של קבוצות כימיות ממולקולה אחת לאחרת. 3. Hydrolases - אנזימים המזרזים ראקציות פירוק של קשרים קוולנטים על ידי הידרוליזה של מולקולת מים. 4. Lyases - אנזימים המזרזים הורדת קבוצה כימית ממולקולה על מנת ליצור קשר כפול בין פחמן לחמצן. 5. Isomerases - אנזימים המזרזים שינוי סדר פנימי של הקשרים במולקולה. 6. Lygases - אנזימים המזרזים חיבור של שתי מולקולות יחד. |
|
|
מהם שני המנגנונים המאתרים את הקישור בין הסובסטרט לאנזים הבאים: 1. Lock and key. 2. Induced fit. |
1. Lock and key - ישנה התאמה מושלמת בין הסובסטרט לאתר הפעיל של האנזים, ברגע שהסובסטרט ייכנס אל האתר הפעיל, הוא ייצור קשרים עם חומצות האמינו על מנת לייצב את מצב המעבר. בנוסף, במנגנון זה ישנה חשיבות לזווית בה הסובסטרט נכנס אל האתר הפעיל של האנזים. 2. Induced fit - במקרה זה אין התאמה מושלמת בין הסובסטרט לאתר הפעיל בהתחלה, לאחר שהסובסטרט נכנס אל האתר הפעיל, נוצר קשר רופף בינו לבין האנזים דבר הגורם לשינוי קונפורמציה של האנזים ליצירת אתר פעיל שמתאים בצורה מושלמת אל המבנה של הסובסטרט. |
|
|
באילו אתרים האנזים הבאים חותכים חלבון? 1. Carboxy peptidase 2. Ser protease 3. Trypsin 4. Chemotrypsin 5. Elastase |
1. Carboxy peptidase - חותך מהקצה הקרבוקסילי של החלבון. 2. Ser protease - חותך במרכז החלבון. 3. Trypsin - חותך במקום בו יש ליזין (Lys, K) או ארגנין (Arg, R). 4. Chemotrypsin - חותך במקום בו יש פנילאלנין (Phe, F), טירוזין (Tyr, Y) או טריפטופן (Trp, W). 5. Elastase - חותך במקום בו יש אלאנין (Ala, A) או גליצין (Gly, G). |
|
|
מהן שלושת ההנחות בהם השתמש מיכאליס מנטן כי להשתמש בתיאור הנובע מן המשוואה שלו? |
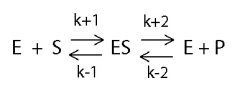
1. התהליך מתחיל מריכוז התחלתי 0 של התוצר (ולכן ניתן להגיד כי K-2 לא קיים). 2. ריכוז האנזים בכל המצבים נמוך משמעותית מריכוז הסובסטרט (לכן ניתן לטעון כי ריכוז הסובסטרט קבוע). 3. המערכת במצב יציב (Steady state) כך שריכוז ES אינו משתנה במהלך התגובה. |
|
|
מהי משוואת מיכאליס מנטן? |
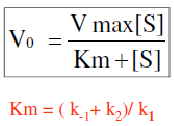
|
|
|
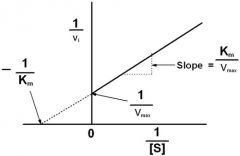
|
|
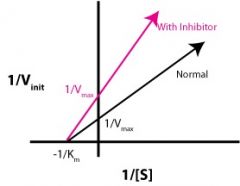
איזה מעכב זה? |
לא תחרותי (Non-competitive) |
|
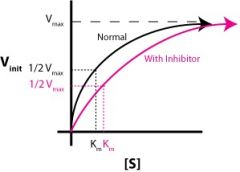
איזה מעכב זה? |
תחרותי (Competitive) |
|
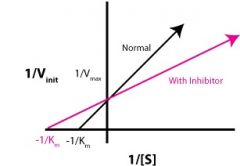
איזה מעכב זה? |
תחרותי (Competitive) |
|
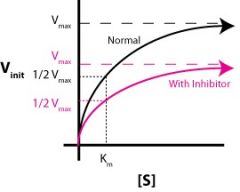
איזה מעכב זה? |
לא תחרותי (Non-competitive) |
|
|
מהם מנגנוני האיטראקציה בין מונומרים של אנזים? |
1. אין שיתופיות - אין תקשורת בין המונומרים ולכן קבועי שווי המשקל זהים תמיד. 2. שיתופיות חיובית - ברגע שהסובסטרט נכנס לאתר פעיל של אחד המונומרים, הוא משנה את המבנה המרחבי של כל שאר האתרים הפעילים באנזים ומעלה את האפיניות שלהם לסובסטרט ולכן קבועי שווי המשקל הבאים קטנים יותר מקבוע שווי המשקל הראשון. 3. שיתופיות שלילית - ברגע שהסובסטרט נכנס לאתר פעיל של אחד המונומרים, הוא משנה את המבנה המרחבי של כל שאר האתרים הפעילים באנזים אך הפעם הוא מוריד את האפיניות שלהם לסובסטרט ולכן קבועי שווי המשקל הבאים גדולים יותר מקבוע שווי המשקל הראשון. |

